今天我们来说mTOR通路,信号通路上百条,mTOR通路凭借其在生理病理上的意义,在众多的通路中脱颖而出。mTOR,全名mammalian target of rapamycin,雷帕霉素受体蛋白,而目前主要的研究集中在哺乳动物,所以加了一个mammalian。
生命活动需要能量,细胞也需要一些生长以及代谢所必须的相关结构和蛋白,于是也需要一些简单的小分子来合成所需物质,能量和这些小分子都是碳水化合物的分解所得。
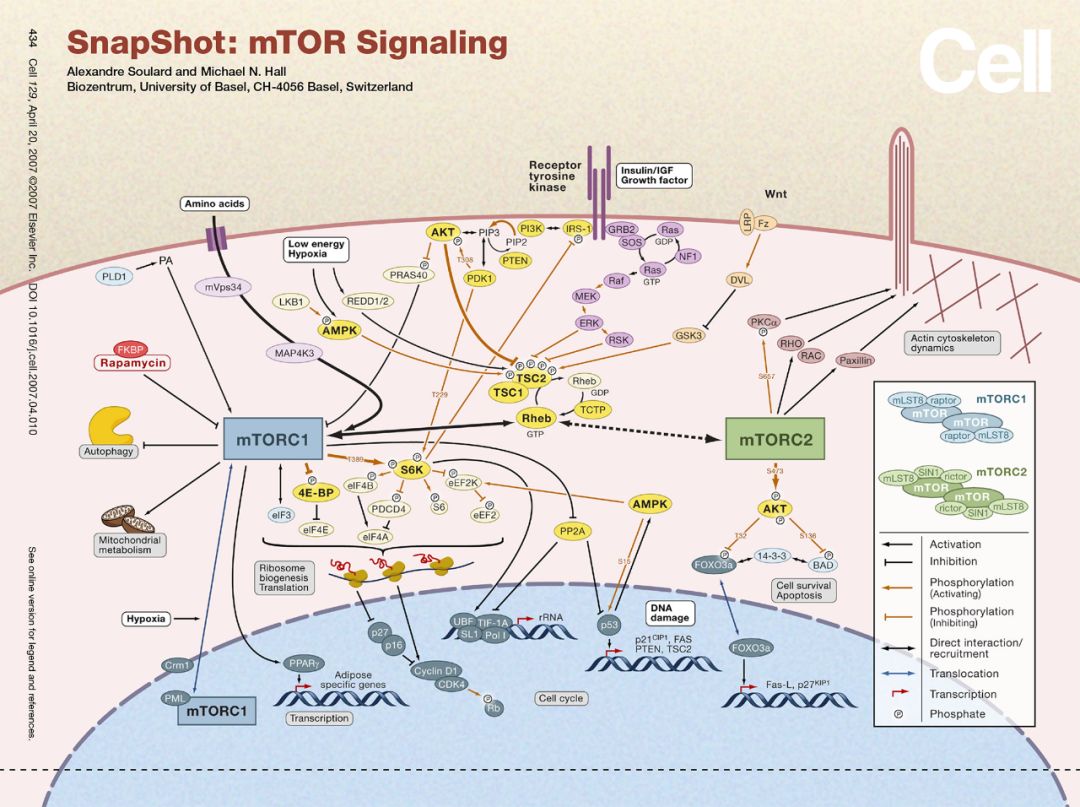
能量的代谢通常都伴随着物质的代谢,物质循环也伴随着能量的产生与利用,这样的过程需要根据细胞与机体的物质和能量的需求状态进行精细的调节以维持生命活动的稳定。而明星分子mTOR则是调节生长与代谢的这样的一个枢纽分子,那它具体是怎么参与代谢调控的呢?
对胰岛素和胰岛素样生长因子的响应
PI3K-AKT-mTOR是经典的响应胰岛素信号的通路。当进食后,被分解的葡萄糖进入血液促进胰岛素的释放,胰岛素作为响应营养富余的信号,会指导细胞进行吸收利用这些营养。
Insulin首先结合细胞表面受体通过IRS1激活PI3K-AKT通路,AKT直接促进Glucose的吸收,同时通过AKT-TSC1/2-RheB-mTORC1激活mTORC1的活性,mTORC1进一步指导合成利用glucose进行生物合成相关的酶进行营养的储存。RheB是一种小G蛋白,小G蛋白激活后可直接调控mTORC1,介导的激素类即细胞表面信号到mTORC1,这是众多mTORC1调节方式中的一种方式。
这一过程既包括吸收也包括吸收后的利用调节,这样一条龙的调节方式,通常被很多科研工作者理解为mTORC1被激活后,既可以合成糖原、可以促进翻译,也可以促进生长。
这样笼统的理解显然是有失偏颇的,也是我们经常对文献理解的一个误区。实际上Insulin激活mTORC1大部分情况下是和糖代谢相关,而IGF(胰岛素样生长因子)激活mTORC1才主要涉及细胞的生长相关。mTORC1激活后分别调控的底物理论上是有差别的,非常具体的调控与底物信息等仍有待进一步研究。
对氨基酸-营养物质的响应
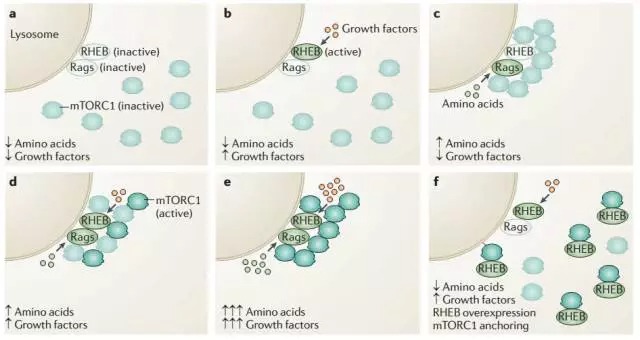
三大营养物质其中糖类,前面已经提到主要通过Insulin与细胞表面受体间接调节mTORC1的活性。而氨基酸被吸收后则可以直接激活mTORC1的活性。Sabatini发现mTORC1的激活主要有2步:
首先在氨基酸存在的情况下,小G蛋白Rags被激活,结合mTOR协助其定位于溶酶体膜表面。然后定位于膜表面的小G蛋白Rheb蛋白被来自生长因子的信号激活后才可以激活mTOR的活性。这里的由氨基酸直接激活mTOR的调节模式虽然不经由来源于细胞表面的信号,也是由小G蛋白Rags所介导。
既然在growth factor和氨基酸都存在的情况下mTOR才可以被完全激活,那也就是在物质和能量都富余的情况下才具备活化mTOR的条件。这一点正说明了mTOR作为代谢调节的枢纽具有信息整合的作用。试想一下,如果glucose富余而氨基酸短缺的情况下,细胞拿什么材料去合成,来完成生长呢?
所以这个时候glucose更多的是用来转化成氨基酸而非能量储存,所以mTOR未被激活。相反在氨基酸富余而glucose不足的情况下,合成所需的能量补给不足,氨基酸这个时候更多的可能会被用来分解而提供细胞活动所需能量,所以mTOR也必然不能被激活。
这正看出mTOR的调节模式也反映了细胞代谢平衡机智的策略。比较有意思的是,两条线路都是经由小G蛋白的信号,那么细胞的代谢稳态比如氨基酸和糖类之间的生化转化的信号如何感知呢?是否小G蛋白参与其中起到重要的作用呢?引人遐想。
对自噬的影响
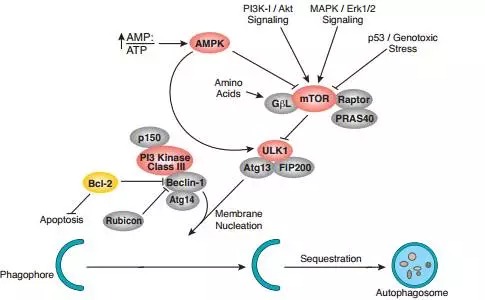
mTOR对自噬的调节本质上也是生长和代谢之间的调节。这其中有营养因素,也有能量因素。自噬是当细胞的营养物质或能量不足时,细胞为了维持自己的基本生存需要,就会通过溶酶体降解一些相对次要的蛋白,以及一些相对多余的细胞器,来供给物质和能量。
除了能量的主要载体ATP相对不足,即AMP/ATP上升,营养供应不足,mTORC1的活性也会不足,于是mTORC1释放了对自噬起始调节的抑制。另一方面来自PI3K-AKT,MAPK cascades信号对mTORC1的调控也体现了生长调节与代谢之间的联系。此外,P53/基因组的稳定性也可直接调节mTORC1的活性,也增加了这方面的证据。
既然mTOR对代谢有这么大的影响,众所周知,肿瘤就是个能耗大户,那抑制mTOR通路是不是就能影响肿瘤的生长呢?
还真有这种研究,雷帕霉素就是经典的mTOR的抑制剂,能够同时抑制住通路中两个大块头mTORC1和mTORC2的活性。那是不是只要用它就能很好的限制住肿瘤呢?
对肿瘤治疗的影响
没那么简单,下面的一个负反馈的图就很好的说明了这个原因。
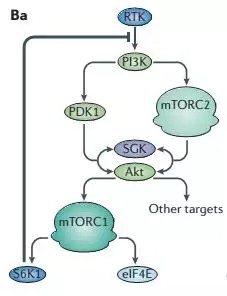
当mTOR被长期抑制后,S6K1的活性也会降低,S6K1对RTK的反馈抑制回路就会被解除,那么,将会有更多的补偿回路来补偿AKT和AGKs这些促进生存的因子,此外S6K1还可以抑制MEK-ERK信号通路,同样雷帕霉素可以解除对MEK-ERK的抑制,抑制临床上表现为雷帕霉素抵抗性。
有研究表明,雷帕霉素并非完全抑制了mTORC1的全部活性,在不同的底物可能各有差别。对于4E-BP1只是短暂或部分抑制其磷酸化,当S6K1-IRS1的负反馈回路使得PI3K-AKT的激活,最终可能还会导致4E-BP1的过磷酸化以及mTORC1其他促进肿瘤的功能。
科学家试图设计mTOR的抑制剂以期对抗肿瘤。竞争ATP结合的抑制剂Torin 1和PP242都有很好的临床疗效,但仍然无法回避S6K1-IRS1的反馈回路。再想下去,如果保持mTORC1的活性保持对AKT活性负反馈的完整性,而只抑制mTORC2的活性。
这样就可以抑制AKT的Ser473的磷酸化抑制其活性,然而后续的研究却发现,虽然AKT的Ser473的磷酸化被抑制,理论上Thr308的磷酸化不会被引发,实际的情况却是在此背景下Thr308位可能通过其他的路径得以补偿,mTORC2的抑制对AKT活性的影响恐怕只会影响到部分底物如FOXO1和FOXO3。
而最近几年的策略集中在对mTOR和PI3K双重抑制剂,这两种蛋白激酶都属于PI3K蛋白激酶家族。从原理上说,它不仅抑制了mTOR的活性,也直接抑制了AKT的活性,所以很好的规避了S6K1-IRS1的反馈回路。双重抑制剂PI-103也展示了良好的杀死淋巴癌的效果,但是这样的双重抑制剂对正常的淋巴组织却一样有毒副作用。针对mTOR的肿瘤治疗方案依然任重道远。
对mTOR靶向治疗肿瘤的尝试也很好的证实肿瘤是一个种调动了整个系统的系统性疾病,这大概是肿瘤难以对付的最重要的原因。对于简单的病因的肿瘤,治疗则相对较为容易。
对于复杂的病因引起的肿瘤,可能最初也是由单因素引起的细胞内部对生长增殖自我约束机制的破坏,而简单点的破坏可能会被自我修复,也可能引起连锁的正反馈的约束的逃逸,引发肿瘤。这好比细胞社会中,如果机体受到的外界因素的伤害不能抵御时,那么细胞个体便会不依赖整体协作而作为个体而努力存活下去。














